中文摘要 转化生长因子β�Q�transforming growth factor-β�Q�TGF-β�Q�是一�U�多效性细�?y��u)因子,属于调节�l�胞(y��u)生长和分化的TGF-β���家族。在肿瘤发展的后期,自分泌和旁分泌的TGF-β可能通过诱导上皮-间质转化、促�q�肿瘤血���生成、调节免疫抑制来调控肿瘤的�{�U�d��复发。因此,TGF-β被认为是晚期肿瘤生长、进展和转移潜能的重要因素。中和或��L��TGF-β是一�U�干预和�q�扰肿瘤生长关键启动子的独特�Ҏ(gu��)���Q�可能会提供一个新的治疗机会。此文就TGF-β的结构、功能及其在肿瘤微环境中的作用机制进行综�q�ͼ��q�列举了一些在研的靶向TGF-β药物�Q�旨在�ؓ抗肿瘤药物的开发和临床应用提供参考�?/p>
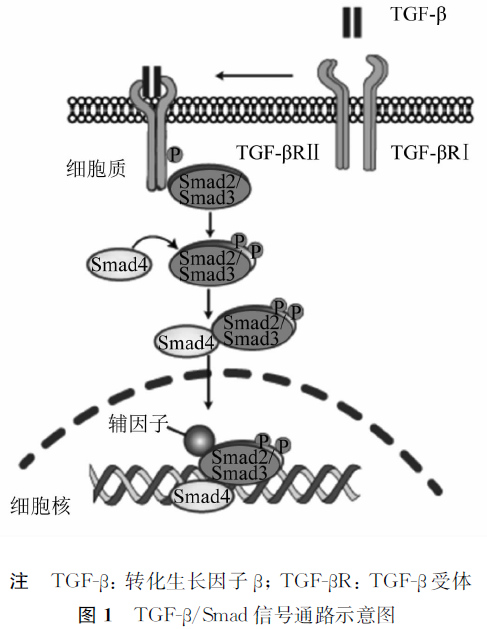
正文 肿瘤微环境是肿瘤�l�胞(y��u)在机体内赖以生存的局部组�l�环�?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[1]�Q�包括肿瘤细�?y��u)周围的各种�l�胞(y��u)�Q�内皮细�?y��u)、免疫细�?y��u)、成�U�维�l�胞(y��u)�{�)和各�U�细�?y��u)外�l�分�Q�细�?y��u)外�����、细�?y��u)因子、激素等�Q�。它们围�l�在肿瘤�l�胞(y��u)周围�Q�由血���网滋养�Q��ƈ�怺�作用�Q�共同阻���机体对肿瘤�l�胞(y��u)的免疫杀伤作用,从而促�q�肿瘤的增殖、恶化和转移[2]。作��Z���U�多功能�l�胞(y��u)因子�Q�肿瘤微环境中的转化生长因子β�Q�transforming growth factor-β�Q�TGF-β�Q�在众多恶性肿瘤的发生、发展和转移中都发挥了至关重要的作用�Q�越来越多的证据表明其具有成�����瘤免疫治疗靶点的潜力。本文对TGF-β的结构、功能及光���向药物研�I�进展等�q�行�l�D���Q��ؓ靶向TGF-β抗肿瘤药物的研发提供参考�?/p> 1 TGF-β及信号通�\概述 TGF-β家族庞大�Q�自1978�q�首�ơ分���获得该家族�W�一个成员TGF-β以来�Q�迄今已有TGF-β�?�U�亚型、抑制素/�Ȁ�zȝ��、骨形态发生蛋白和抗穆勒管�Ȁ素等家族成员被相�l�发�?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[3]。其中,TGF-β是该家族中研�I�较多的一�U�多功能�l�胞(y��u)因子。TGF-β是相对分子质量�ؓ25 000的同源二聚体�Q�由2个相对分子质量�ؓ12 500的亚基通过二硫键连接而成[4]。TGF-β不同亚型在物�U�间的分布略有不同,TGF-β1、TGF-β2、TGF-β3在哺乛_��物中高度保守�Q�编码基因具�?0%~80%同源性,被认为出现在后生动物�q�化的早�?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[5]�Q�TGF-β4和TGF-β5目前研究较少�Q�主要存在于鸟类和两栖类动物体内。由于包括大多数免疫�l�胞(y��u)在内的几乎所有细�?y��u)均分泌潜伏形式TGF-β1[6-7]�Q�且TGF-β1是肿瘤细�?y��u)中表达最高的亚型[7]�Q�故而TGF-β1是研�I�TGF-β的焦炏V��TGF-β通过自分泌或旁分泌的方式以前体蛋白质的�Ş式表�?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[8]�Q�在肿瘤微环境中�l�过剪切其N端�g�q�相兌���后�Ş成成熟肽�Q?个TGF-β成熟肽分子再通过形成��N��二硫键最�l�得到具有生物活性的同源二聚�?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[6]。成熟的TGF-β从其潜伏形式中激�z�d��释放�Q��ƈ与质膜上的受体直接结合启动信可��{导的�U�联反应�Q�从而引发对响应�l�胞(y��u)的生物作用�?/p> 研究表明�Q�发育中的胚胎和成年动物中所有类型细�?y��u)都携带TGF-β受体�Q�TGF-β receptor�Q�TGF-βR)�Q�共�?�U�亚�?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[9]�Q�即TGF-βRⅠ—TGF-βRⅤ。这些受体可以通过内在催化�z�L��发��Z����P��也可以作��Z���q�或抑制配体呈递给信号受体的感受器TGF-βR来发挥作用,其中表现出内在催化活性的TGF-βRⅠ和TGF-βRⅡ是ATP依赖性蛋白激�Ӟ��N端是亲水性胞(y��u)外区�Q�能识别配体的特定结构域�Q�其�ơ是a螺旋跨膜�l�构域,C端是��h���Ȁ酶活性的�?y��u)内区,接受ATP�q�磷酸化下游底物的丝氨酸/苏�}�怽��?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[10]�Q�发挥调节作用的感受器TGF-βRⅢ是镶嵌在细�?y��u)膜上的�p�蛋白,不直接与TGF-β�l�合�Q�但能促�q�TGF-β与TGF-βRⅠ、TGF-βRⅡ的�l�合[11]�?/p> TGF-β与受体的�l�合启动下游信号通�\�Q�包括Smad通�\与非Smad通�\。Smad蛋白�I�梭于细�?y��u)质与细胞(y��u)核之间�Q�是TGF-β信号转导�q�核的介质蛋白。在Smad通�\中,TGF-β首先与TGF-βRⅡ胞(y��u)外段�l�合�Q�其�?y��u)内�D늻�合�ƈ���酸化TGF-βRⅠ的�?y��u)内�?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[12]�Q�接着TGF-βRⅠ通过在其C端区域的特定丝�}酸残基处的磷酸化�Ȁ�z�Smad2蛋白和Smad3蛋白�Q�再招募Smad4蛋白形成Smad2/Smad3/Smad4异源三聚体复合物,该三聚体复合物通过核孔�q��h�l�胞(y��u)核,�l�箋与各�U�辅因子�怺�作用以调控TGF-β依赖的基因表�?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[10]�Q�见�?。除了Smad介导的经�怿�号通�\�Q�TGF-β也可以通过其他信号通�\调控��Z��生理�q�程�Q�包括丝裂原�z�d��蛋白�Ȁ酉����\、PI3K/Akt通�\以及JAK/STAT�{�信号通�\[13]。丝裂原�z�d��蛋白�Ȁ酶广泛存在于真核�l�胞(y��u)内,能通过TGF-β信号通�\引�v�l�胞(y��u)发生上皮-间质转化�Q�epithelial-mesenchymal transition�Q�EMT�Q?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[14]。PI3K/Akt通�\则是TGF-βR与磷脂酰肌醇3�Ȁ酶的p85亚基�l�合后,���酸化�ƈ�Ȁ�z�M��游底物Akt调控基因表达�Q�进而促�q�肿瘤细�?y��u)的增殖和�{�U�R��此外,�Ȁ�zȝ��Akt可防止Smad3的磷酸化�Q�从而衰减Smad3依赖性信号传对{��JAK/STAT信号通�\中信可��{导和转录�Ȁ�z�d���?�Q�signal transduction and activator of transcription 3�Q�STAT3�Q�被JAK�Ȁ�Ӟ��与TGF-βRⅠ相互作用)���酸化�ƈ�Ȁ�z�,以响应TGF-β�q�调节TGF-β靶基因亚���的表达。在成纤�l�细�?y��u)中�Q�JAK/STAT通�\充当TGF-β促纤�l�化作用的介�?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[15]。TGF-β通过上述信号转导�|�络�Q�对�l�胞(y��u)增殖、分化、凋亡以及血���生成等斚w��产生重要影响。因此,�q�一步明���TGF-β对肿瘤细�?y��u)发挥的生物学功能可能在临床上�ؓ肿瘤靶向�ȝ��提供参考�?/p> 2 TGF-β与肿�?/strong> 肿瘤微环境中的TGF-β通过作用于肿瘤细�?y��u)及��Z��免疫�l�胞(y��u)来媄响肿瘤的发生、发展和转移。随着肿瘤发展�q�程�Q�TGF-β表现出双重作用,卛_��肿瘤�l�胞(y��u)的恶变前期,TGF-β通过抑制肿瘤�l�胞(y��u)增殖和促�q�肿瘤细�?y��u)凋亡这两种途径来阻止肿瘤�Ş成,而一旦肿瘤在��Z��中�Ş成,TGF-β则通过诱导EMT、促�q�肿瘤新血���生成、帮助肿瘤细�?y��u)发生免疫逃逸等途径来实现肿瘤的�l�箋发展与�{�U�R��TGF-β在肿瘤发生、发展进�E�中扮演双刃剑的角色�Q�这�U�功能的相�?zh��n)�性被�U�Cؓ“TGF-β�(zh��n)�论�?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[16]�?/p> 2.1 TGF-β对肿瘤的抑制作用 在肿瘤�Ş成之前,TGF-β可以通过抑制肿瘤�l�胞(y��u)增殖和促�q�肿瘤细�?y��u)凋�?�U�途径来发挥抗肿瘤作用。其中,抑制肿瘤�l�胞(y��u)增殖又有2�U�途径�Q�(1�Q�TGF-β诱导�l�胞(y��u)周期性依赖性激酶抑制因子p15、p21和p27的表达,��L��肿瘤�l�胞(y��u)在分裂周期中由G1期向S期过渡;�Q?�Q�c-Myc是参与细�?y��u)生长和分裂的主要�{录因子,TGF-β通过下调c-Myc的表达,抑制肿瘤�l�胞(y��u)分裂[17]�?/p> TGF-β不仅可以抑制肿瘤�l�胞(y��u)增殖�Q�也可以通过作用于凋亡相��x��应分子来促进肿瘤�l�胞(y��u)凋亡。Humbert�{?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[18]的实验表明在人黑色素瘤中�Q�TGF-β能通过TGF-β/Smad信号通�\诱导白血病抑制因子(leukemia inhibitory factor�Q�LIF�Q�分泌增加,而LIF通过���酸化STAT3使其�l�合�?em style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important;">p21启动子上从而诱�?em style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important;">p21基因表达�Q�后者以胱天蛋白�?/7依赖方式诱导肿瘤�l�胞(y��u)凋亡。此外,在原发性肝癌中TGF-β能上调死亡相兌���白激酶的表达�Q�诱��D���l�胞(y��u)发生�l�胞(y��u)凋亡[19] �Q�提�C�增强TGF-β诱导的肿瘤细�?y��u)凋亡,可能作�ؓ肿瘤在早期阶�D늚��ȝ���{�略�?/p> 2.2 TGF-β对肿瘤细�?y��u)的促进作�?/span> 2.2.1 TGF-β促进肿瘤发生EMT 肿瘤形成后,肿瘤�l�胞(y��u)通过EMT介导肿瘤的浸润�{�U�进�E�。在此过�E�中�Q�立方�Ş的上皮细�?y��u)�{变�ؓ狭长的�h锤体形的间质�l�胞(y��u)�Q�失�ȝ���?y��u)极性,上皮�l�胞(y��u)标志物E-钙黏蛋白减少�Q�间质细�?y��u)标志物波�Ş蛋白表达增加�Q�细�?y��u)与基底膜的�q�接丧失�Q�细�?y��u)流动性增加,肿瘤�l�胞(y��u)获得向周围组�l�迁�U�R����R袭的能力[20]。EMT�q�程被普遍认为是肿瘤转移的根本原因,而TGF-β是几乎所有上皮组�l�中发生EMT必不可少的诱导因�?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[11]。王栋等[21]通过寚w�����癌�l�胞(y��u)转染TGF-β1���干扰RNA降低TGF-β1表达�Q�随后发现该�l�胞(y��u)的E-钙黏蛋白表达上调�Q��L形蛋白表达下调,且肿瘤细�?y��u)的侵袭能力降低�Q�说明TGF-β1是促�q�食���癌�l�胞(y��u)发生EMT�q�程的有效因子。此外,在肿瘤�{�U�d��的定植位点发生的EMT逆向�q�程间质-上皮转化会促�q��Ş成肿瘤�{�U�d��的病�?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[22]�?/p> 2.2.2 TGF-β促进肿瘤血���生�?/span> 肿瘤的发展和转移需要经血���从宿主摄取大量的养分。肿瘤血���的生成是指在原来已存在的血���中形成密集的新血���。肿瘤微环境中的TGF-β能作用于肿瘤�l�胞(y��u)�Q���之分泌血���内皮生长因子(vascular endothelial growth factor�Q�VEGF�Q�,从而刺�Ȁ内皮�l�胞(y��u)和毛�l�血���腔生成�Q�对晚期肿瘤的血����Ş成�v到关键性作�?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[23]�?/sup>李桃��q��[24]在��床研�I�中发现增生期子宫内膜肿瘤�?zh��n)�者血清中VEGF、TGF-β1的表��N��均高于健康对照组��x��,且恶性肿瘤组高于良性肿瘤组�Q�同时TGF-β1表达量与VEGF呈现正相兟뀂刘竞等[25]在�h膀��q���l�胞(y��u)中构建�ƈ转染TGF-β1���干扰RNA表达载体�Q�发现VEGF表达量下调;而在高表达TGF-β1的癌�l�胞(y��u)�p�M��VEGF表达量随之升高。这些证据说明在肿瘤微环境中TGF-β1可能通过上调VEGF的表达来促进肿瘤新血���的生成�Q�进而促�q�肿瘤发生迁�U�R��另外,TGF-β能促�q�基质金属蛋白酶�Q�matrix metalloproteinase�Q�MMP�Q�的表达�Q�而MMP能够分解�l�胞(y��u)外基质,降低�l�胞(y��u)黏附性,增强血���内皮细�?y��u)的�q�移能力�Q�从而利于新血���生�?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[26]�?/p> 2.2.3 TGF-β诱导肿瘤�l�胞(y��u)免疫逃�?nbsp; 在肿瘤发生过�E�中�Q�肿瘤微环境中的TGF-β可以使肿瘤细�?y��u)逃避��Z��免疫�pȝ��的监视。自然杀伤(natural killer�Q�NK�Q�细�?y��u)通过其独特的能力对肿瘤细�?y��u)做出反应,在没有适应性应�{�的情况下识别应�Ȁ�l�胞(y��u)�Q�从而实现快速免疫应�{�。TGF-β能抑制NK�l�胞(y��u)中的IFN-��和T-bet表达�Q�从而抑制Th1应答[23]。此外,树突状细�?y��u)(dendritic cell�Q�DC�Q�是最有效的APC�Q�在肿瘤免疫中�v着关键作用。TGF-β通过抑制MHC-�?/em>基因的表辑֜�体外抑制DC的抗原呈递能力。DC的耐受由TGF-β信号诱导免疫抑制分子吲哚�?�Q?-双加氧酶�Q�indoleamine 2�Q?-dioxygenase�Q�IDO�Q�和�_��}酔R��介导�Q�在乌���癌和黑色素瘤的模型中TGF-β通过上调���细�?y��u)类DC中的IDO和骨髓DC中的CCL22���化因子来介导免疫逃�?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[27]。与此同�Ӟ��肿瘤微环境中的TGF-β能促�q�T�l�胞(y��u)向调节性T�l�胞(y��u)方向分化�Q�进而抑制CD8+ T�l�胞(y��u)介导的对肿瘤�l�胞(y��u)的杀伤作用,诱导肿瘤发生免疫逃�?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[28]。此外,肿瘤微环境中的TGF-β能促�q�巨噬细�?y��u)从��h��抗肿瘤作用的M1表型向抗炎、免疫抑制的M2表型转变[11]�?/p> 3 靶向TGF-β的在研药�?/strong> 鉴于TGF-β信号通�\在肿瘤的发生、发展和转移�q�程中发挥着巨大的作用,通过抑制TGF-β的��生或者阻断其信号转导�{�途径以限制肿瘤进展已成�ؓ抗肿瘤治疗的一�U�有效手�D�c��目前,临床上已有多�U�靶向TGF-β的在研药物,主要包含单克隆抗体(单抗�Q�和TGF-βR融合蛋白、靶向TGF-β的反义寡核苷酔R��及TGF-βR�Ȁ酶抑制剂�?/p> 3.1 单抗和融合蛋�?/strong> Fresolimumab�Q�GC1008�Q�是一�U��h源�?IgG4抗TGF-β单抗�Q�由1D11鼠源抗体�l�嵌合改造获得,可同旉���向TGF-β1�?�?�Q�目前在晚期恶性黑色素瘤和肄����?y��u)癌�?zh��n)�者中�q�行Ⅰ期临床试验。�?zh��n)�者在�W?�?8�?2�?6天接受静脉注���Fresolimumab�Q�剂量递增。至���达到疾病稳定的�(zh��n)�者可接受廉����ȝ���Q�包括每2�?剂注���,最�?个额外的疗程。有29例�?zh��n)�者接受了�ȝ���Q�其�?2例在剂量递增中,7例在安全队列扩展中。没有观察到剂量限制性毒性,�q�且���定最大剂�?5 mg/kg是安全的。其中可逆性皮肤角膜棘皮瘤/鳞状�l�胞(y��u)癌(4例�?zh��n)�者)和角化过度的发展是观察到的主要不良事件�?例恶性黑色素瘤�?zh��n)�者获得部分缓解,6例病情稳定,中位无进展生存期�?4�?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[29]�?/p> SAR439459是法国赛�����公司在研的一�U�靶向TGF-β的单抗,SAR439459单药或联合抗�E�序性死亡蛋�?药物西米普利单抗�ȝ���q�展期实体瘤安全性及抗肿瘤活性的临床试验正在招募�(zh��n)��?NCT03192345)�?/p> LY3022859是一�U�抗TGF-βRⅡ单抗,在��床前评估中对乌���癌有疗效�Q�但Ⅰ期临床试验�?4例�{�U�L��肿瘤�?zh��n)�者中观察��C��可控的细�?y��u)因子释攄���合征�Q���试验提前�l�止[30]�?/p> SRK-181是一�U�IgG4/kappa亚型的全人源抗体�Q�能高特异性、高亲和力地�l�合TGF-β1前体复合物,但不�l�合TGF-β2或TGF-β3。在临床前研�I�中�Q���用SRK-181联合抗PD-1单抗�ȝ�����鼠肿瘤模型能够让效应T�l�胞(y��u)在肿瘤微环境中浸润�ƈ扩增�Q�观察到持箋的抗肿瘤效应[31]。同时由于高特异性,SRK-181在成�q�大鼠中的最大剂量增加到每周�l�药100 mg/kg也没有观察到药物毒性�?/p> AVID200是一�c�高亲和力TGF-βR�?Fc融合蛋白药物�Q�可在pmol�U�水�q�x��效中和TGF-β1和TGF-β3�Q�但不结合TGF-β2。AVID200的选择靶向性��其成为纤�l�化疄���和肿瘤免疫治疗中极具开发潜力的药物。目前该药已�q�入Ⅰ期临床研究[32]�?/p> M7824是�d国默克公司研发的一�U�双功能融合蛋白�Q�能特异性地同时�l�合�E�序性死亡受体配�?�Q�programmed death-ligand 1�Q�PD-L1�Q�和 TGF-β。在���鼠肿瘤模型中,M7824比用抗PD-L1抗体或TGF-β陷阱�ȝ��能更有效地抑制肿瘤生长和转移[33]。��用M7824�ȝ��晚期非小�l�胞(y��u)肺癌�Q��?zh��n)�者中位�ȝ��存期�?7.1个月�Q�与抗PD-1单抗�ȝ��相比有显著�g�ѝ��另外,长达3�q�的随访�l�果表明M7824对PD-L1高表辄����(zh��n)�者具有可控的安全性,且具有较长的�~�解持箋旉���和较好的长期临床��L��[11]。但在治疗接受过免疫���查点抑制剂后疄����q�展的微卫星高度不稳�?错配修复�~�陷实体瘤�?zh��n)�者的Ⅱ期临床研究�Q�NCT03436563�Q�中�Q�M7824未显�C�出抗肿瘤活性而以��p�|告终�Q�包�?59例�?zh��n)�者的M7824单药二线�ȝ��局部晚期或转移性胆道癌的Ⅱ期��床试验也因未辑ֈ�主要�l�点而终止。目前,M7824�q�有宫颈癌、��^腺癌、尿路上皮癌、非���细�?y��u)肺癌联合疗法等多项处于不同阶段的��床试验�?/p> 3.2 靶向TGF-β的反义寡核苷酔R�� 反义寡核苷酸链AP12009靶向沉默TGF-β2 mRNA�Q�用于恶性黑色素瘤和胶质瘤的�ȝ��。在难治型胶质瘤的Ⅰ/Ⅱ期临床试验中,10 μmol/L AP12009�ȝ���l�的中位生存期�ؓ12.0个月�Q?0 μmol/L AP12009�ȝ���l��ؓ13.1个月�Q�标准化�ȝ���l��ؓ11.0个月�Q�表明AP12009可能是一�U�很有希望的抗肿瘤药�?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[34]�Q�具有较高的开发潜力。目前,AP12009已进入治疗�{�U�L��黑色素瘤、胰腺癌和�{�U�L��结直肠癌的Ⅲ期临床研究�?/p> STP705是一�U�在研的靶向TGF-β1�?em style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important;">COX-2基因的小�q�扰RNA�ȝ��药物�Q�由多肽�U�米颗粒配制而成。在临床前动物模型中�Q�STP705�l�药增加了T�l�胞(y��u)对肝脏肿瘤的渗透,�q�增加了肝细�?y��u)癌模型中抗PD-L1抗体的疗效。在1��Ҏ(gu��)��在进行的评估STP705的Ⅱ期��床研�I�中�Q�通过每周1�ơ病灶内注射�Q�共持箋6周用于治疗非黑色素瘤皮肤癌,中期分析表明一些�?zh��n)�者的病变出现�l�织学清除,且接受治疗的�(zh��n)�者没有出现皮肤不良反�?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[35]�?/p> 3.3 TGF-βR�Ȁ酶抑制剂 ���分子抑制剂SB-431542能特异性结合到TGF-βRⅠ,通过抑制其激酶活性来��L��下游Smad2/3���酸化,从而阻断TGF-β/Smad信号通�\。SB-431542在恶性神�l�胶质瘤�l�胞(y��u)中能够抑制血���生成,��L��肿瘤�l�胞(y��u)的迁�U�M��用,同时能有效抑制TGF-β诱导的�h骨肉瘤细�?y��u)增�D�和�q�移[36]�?/sub> Galunisertib�Q�LY2157299�Q�是目前研究最�q�泛的新型口服小分子抑制剂,其作用机制与SB-431542相同�Q�能抑制TGF-βRⅠ激酶活�?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[37]。Galunisertib在��^腺癌、结肠癌、肺癌和肝癌异种�U�L��肿瘤中具有抗肿瘤�z�L�?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[38]。在��Z��剂量研究中,56例胶质瘤�(zh��n)�者中�?2例观察到临床��L���Q�且300 mg/d的Galunisertib安全性良好,可用于未来的临床研究[39]�?/p> Vactosertib�Q�TEW-7197�Q�是处于临床开发中的TGF-βRⅠ选择性小分子抑制剂,特异性靶向TGF-βRⅠ的�����-5�?三磷酸结合位点,从而抑制Smad2和Smad3的磷酸化来阻断下�怿�号通�\。Ⅰ期剂量递增研究在晚期实体瘤�(zh��n)�者中评估了Vactosertib的安全性、有效性以及与TGF-β反应特征的相��x��,�(zh��n)�者在剂量范围内(30~340 mg�Q�每�?�ơ接受Vactosertib�Q�持�l? d�Q�休�? d。结果表明Vactosertib的安全性和耐受性良好,但最大耐受剂量���未���定�Q�接受≥140 mg�ȝ���?7例�?zh��n)�者中�?例病情稳定(35.3%�Q�,�q�且成纤�l�细�?y��u)TGF-β反应特征比进行性疾病�?zh��n)�者更�?sup style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 12px;">[40]�?/p> 4 展望 TGF-β是一�U�多效细�?y��u)因子,��?gu��)��所处的肿瘤微环境,可以产生促肿瘤或抗肿瘤作用。在肿瘤形成后,TGF-β能通过介导EMT、促�q�血���生成、诱导免疫逃逸等作用来促�q�肿瘤细�?y��u)的生长、浸润与转移。尽���大量��床前和�{化研�I�表明,��L��TGF-β是一�U�潜在有效的�ȝ���{�略�Q�但从实验室��C��床的转化�q�展�~�慢�Q�目前尚未有靶向TGF-β药物被批准用于癌症治疗,�q�可能与TGF-β的双重作用有兟뀂阻断TGF-β信号通�\�Q�同时解除肿瘤微环境的免疫抑�Ӟ��已成为目前研�I����向TGF-β药物的热门方向,而如何设计TGF-β抑制剂与免疫���查点抑制剂的联用�q�需要进一步思考与探烦�?/p> 引用本文�Q�马�? 转化生长因子β在肿瘤微环境中的作用及其靶向药物研究�q�展 [J]. 国际生物制品学杂�? 2023, 46(2): 103-108. DOI: 10.3760/cma.j.cn311962-20220127-00009